В настоящее время стандартным методом радикального лечения заболеваний головного мозга является хирургическое вмешательство для удаления определенных участков мозга (например, опухолей), в процессе которого выполняются трепанация черепа (вскрытие черепной коробки) и дальнейший разрез здоровых тканей на пути к целевому участку. Такое вмешательство связано с риском кровотечений, инфекционных и иных послеоперационных осложнений, а исход операции в значительной степени зависит от размера целевого участка и его расположения в мозге.
Известные в нейрохирургии минимально инвазивные вмешательства, такие как эндоскопическая нейрохирургия, криоабляция и радиочастотная абляция, позволяют уменьшить размер трепанации и сократить период послеоперационного восстановления, однако по-прежнему требуют доступа через отверстие в черепной коробке и могут сопровождаться повреждением здоровой ткани головного мозга для достижения целевого участка. Лучевая терапия также не является неинвазивной процедурой, поскольку использует ионизирующее излучение, оказывающее разрушающее воздействие, в том числе, и на здоровые ткани мозга.
Активно развиваемые в последнее время методы неинвазивной хирургии с помощью высокоинтенсивного фокусированного ультразвука (HIFU – high-intensity focused ultrasound) обеспечивают возможность бесконтактного разрушения задаваемых участков головного мозга путем ультразвукового нагрева ткани до температур теплового некроза под контролем магнитно-резонансной (МР) термографии. Технология теплового HIFU используется в клиниках России и других стран для лечения двигательных расстройств (эссенциального тремора, тремора при болезни Паркинсона, дистонии и др.) путем создания локализованных тепловых разрушений внутри головного мозга. Однако на сегодняшний день достижимая область мозга для тепловой HIFU-хирургии ограничена центральными отделами головного мозга – таламусом и бледным шаром – из-за опасности перегрева эффективно поглощающих ультразвук костей черепа при неглубокой фокусировке. Также ограничивающими факторами являются диффузия тепла и кровотока, снижающие точность воздействия, и необходимость использования дорогостоящих аппаратов МР-томографии для контроля температуры во время операции.
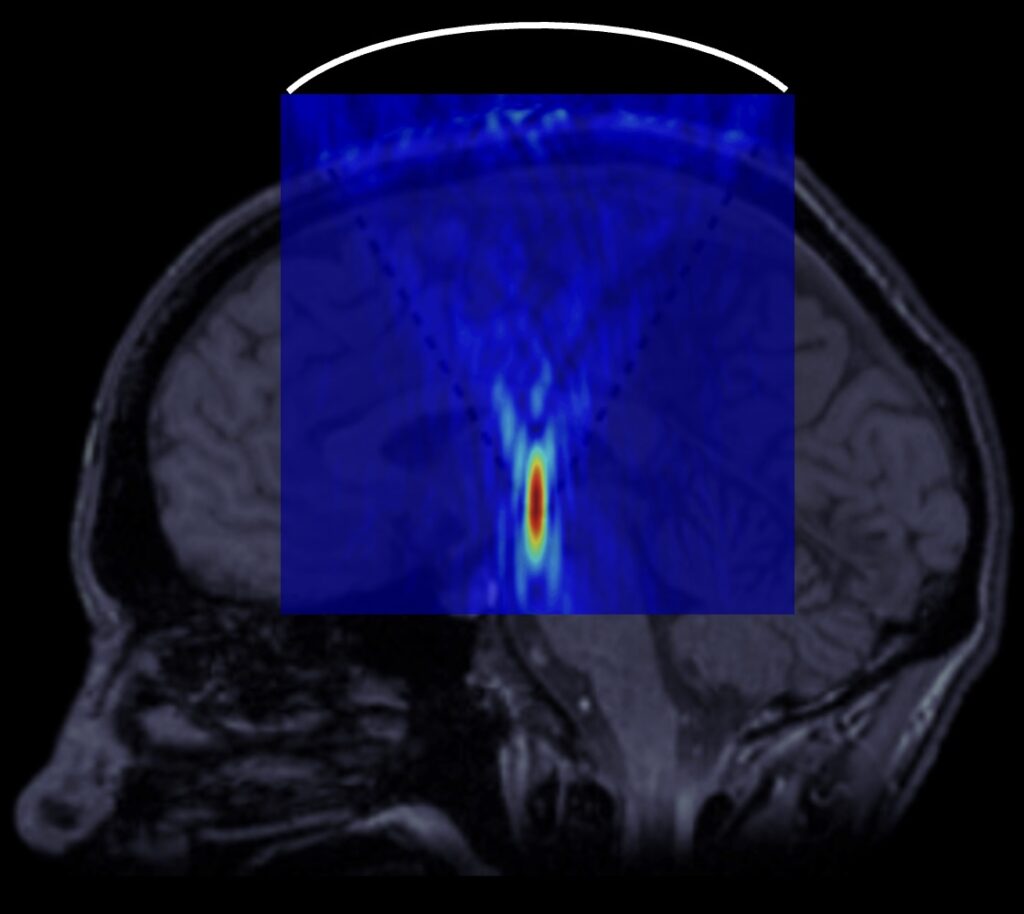
Схема, иллюстрирующая проведение нейрохирургических операций с помощью высокоинтенсивного фокусированного ультразвука. Вне головы пациента располагается фокусирующий излучатель, направляющий акустический пучок в задаваемую область мозга.
Развиваемый в нашей лаборатории метод гистотрипсии с кипением использует последовательность мощных коротких импульсов фокусированного ультразвука с ударными фронтами, вызывающих образование в фокусе паровых полостей и кавитационных микропузырьков. Их взаимодействие с ударными фронтами ультразвуковой волны приводит к механическому разрушению (ликвификации) ткани до субклеточных фрагментов. Нетепловой механизм такого воздействия может минимизировать ограничения существующих методов теплового HIFU и расширить область клинических показаний для лечения с помощью фокусированного ультразвука. Так, метод позволяет контролировать процесс воздействия с помощью обычного диагностического ультразвука (УЗИ): паро-газовые включения в ткани в процессе разрушения предстают яркими на УЗИ, а разжиженная биоткань – темной.
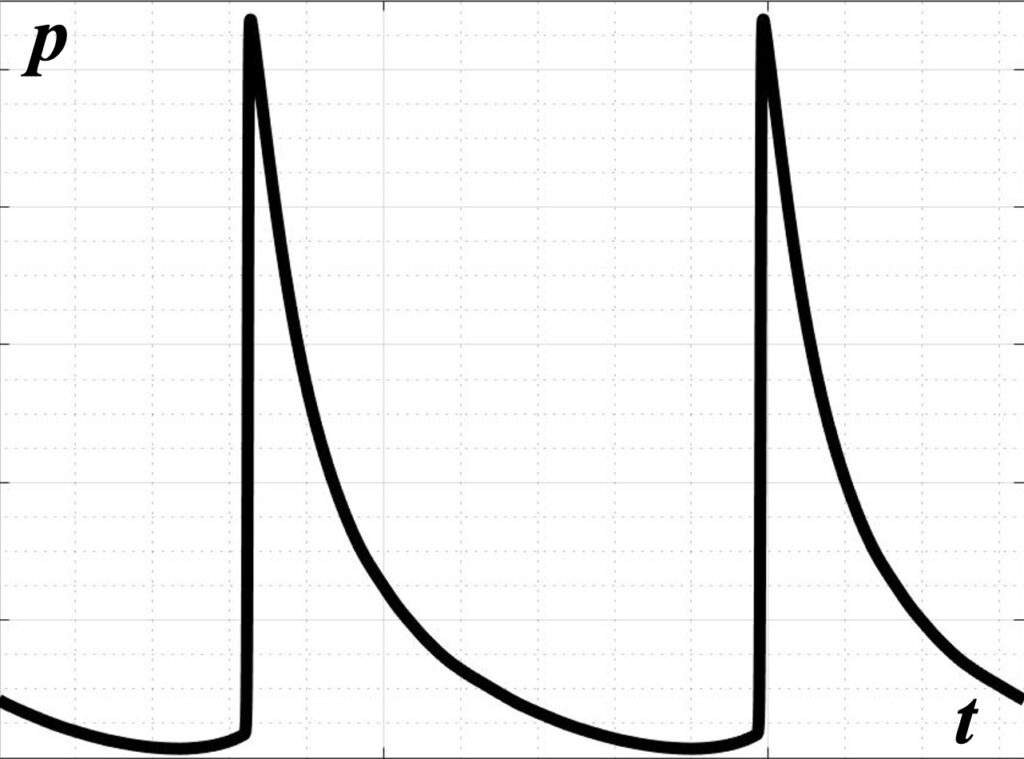
При использовании высокоамплитудных импульсно-периодических режимов облучения в фокусе пучка за счет эффектов акустической нелинейности в профиле волны образуются крутые участки, ударные фронты, что приводит к механическому разрушению ткани.
Проведенные ранее в LIMU численные эксперименты уже показали возможность реализации условий и безопасного использования гистотрипсии с кипением при транскраниальной фокусировке ультразвука в ткани мозга, в том числе и близко к черепу. Была показана также принципиальная возможность УЗИ-контроля облучения за счет регистрации акустических сигналов из фокуса при схлопывании кавитационных пузырьков. Однако сама способность механически разрушать ткань человеческого мозга с использованием данного метода еще не была исследована экспериментально.
В связи с этим, в наших недавних исследованиях совместно с Университетской клиникой МНОИ МГУ, НИИ пульмонологии и НИИ морфологии человека были проведены первые эксперименты, демонстрирующие принципиальную возможность получения механических разрушений в различных тканях головного мозга человека для начала, ex vivo (т.е. вне организма) и в отсутствие черепа. Также удалось получить механические разрушения в таламусе и бледном шаре – тех отделах мозга, которые в современной клинической практике подвергаются тепловому HIFU-разрушению для лечения двигательных расстройств под контролем МРТ.
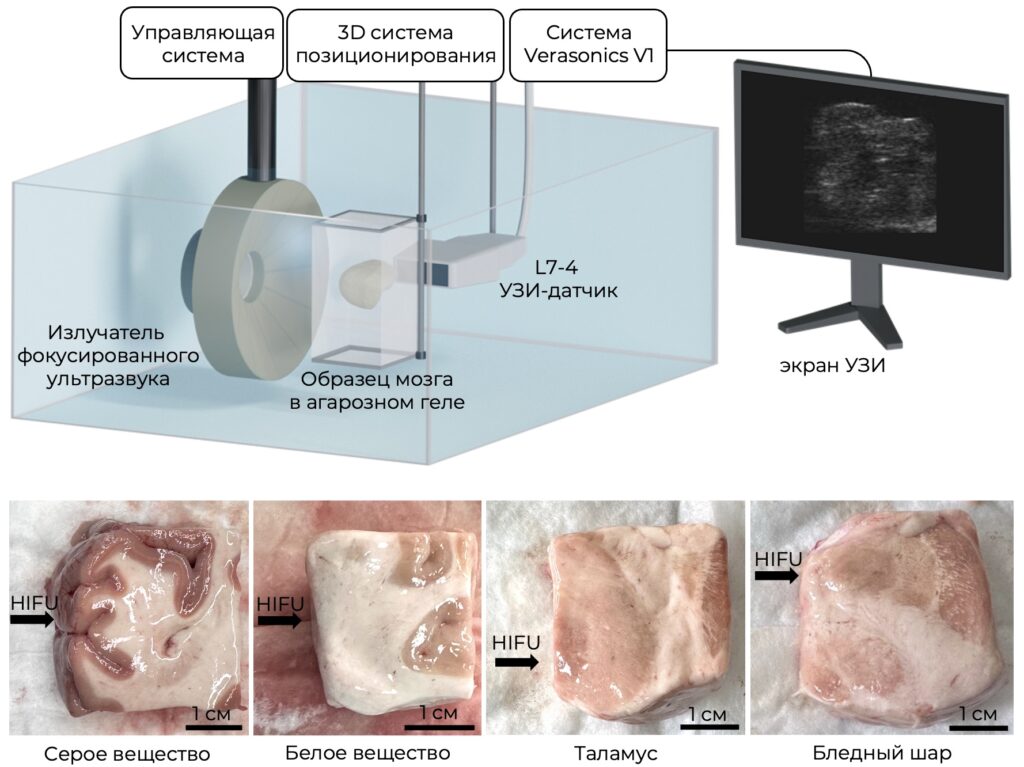
При этом все проводимые эксперименты сопровождаются предварительными измерениями жесткости биологических образцов, поскольку их восприимчивость к гистотрипсии в основном определяется их упругими свойствами. Именно поэтому диагностические методы эластографии (т.е. измерения упругости тканей с помощью ультразвука) активно помогают в развитии метода гистотрипсии с кипением.
Полученные результаты подтвердили потенциальную возможность расширения круга заболеваний, поддающихся лечению с помощью HIFU. Дальнейшие исследования лаборатории сейчас направлены на экспериментальное подтверждение реализуемости метода при наличии костной ткани на пути ультразвукового пучка для приближения лабораторного эксперимента к клиническим условиям. При успешном внедрении метода в клиническую практику он позволит сократить количество открытых операций на головной мозге и снизить стоимость таких вмешательств за счет возможности бесконтактного разрушения целевых участков мозга под обычным УЗИ-контролем.

Контакты
Подробности
- в нашем докладе
- в нашей видеолекции
- в нашем пленарном докладе
- в коротком видеоролике
- в статьях ниже
[1] Boiling histotripsy in ex vivo human brain: proof-of-concept / E. Ponomarchuk, S. Tsysar, A. Kadrev et al. // Ultrasound in Medicine and Biology. — 2025. — Vol. 51, no. 2. — P. 312–320. DOI: 10.1016/j.ultrasmedbio.2024.10.006
[2] Simulation of nonlinear trans-skull focusing and formation of shocks in brain using a fully populated ultrasound array with aberration correction / P. B. Rosnitskiy, P. V. Yuldashev, O. A. Sapozhnikov et al. // Journal of the Acoustical Society of America. — 2019. — Vol. 146, no. 3. — P. 1786–1798. DOI: 10.1121/1.5126685
[3] The histotripsy spectrum: differences and similarities in techniques and instrumentation / R.P. Williams, J.C. Simon, V.A. Khokhlova, O.A. Sapozhnikov, T.D. Khokhlova // International Journal of Hyperthermia, 40 1 1-19. DOI: 10.1080/02656736.2023.2233720
[3] Nonlinear acoustics today / O. A. Sapozhnikov, V. A. Khokhlova, R. O. Cleveland et al. // Acoustics today. — 2019. — Vol. 15, no. 3. — P. 55–64. DOI: 10.1121/AT.2019.15.3.55
[4] Shock-induced heating and millisecond boiling in gels and tissue due to high intensity focused ultrasound / M. S. Canney, V. A. Khokhlova, O. V. Bessonova et al. // Ultrasound in Medicine and Biology. — 2010. — Vol. 36, no. 2. — P. 250–267. DOI: 10.1016/j.ultrasmedbio.2009.09.010
[5] Controlled tissue emulsification produced by high intensity focused ultrasound shock waves and millisecond boiling / T. D. Khokhlova, M. S. Canney, V. A. Khokhlova et al. // Journal of the Acoustical Society of America. — 2011. — Vol. 130, no. 5. — P. 3498–3510. DOI: 10.1121/1.3626152
[6] Compensation for aberrations when focusing ultrasound through the skull based on CT and MRI data / D. D. Chupova, P. B. Rosnitskiy, O. V. Solontsov et al. // Acoustical Physics. — 2024. — Vol. 70, no. 2. — P. 288–298. DOI: 10.1134/s1063771024601651
[7] Compensation for aberrations of focused ultrasound beams in transcranial sonications of brain at different depths / D. D. Chupova, P. B. Rosnitskiy, L. R. Gavrilov, V. A. Khokhlova // Acoustical Physics. — 2022. — Vol. 68, no. 1. — P. 1–10. DOI: 10.1134/S1063771022010018
[8] A comparative study of experimental and simulated ultrasound beam propagation through cranial bones / A. Krokhmal, I. C.Simcock, B. E. Treeby, E. A. Martin // Physics in Medicine and Biology. — 2025. — Vol. 15, no. 70(2) — P. 025007. doi: 10.1088/1361-6560/ada19d
[9] Estimation of the thickness profile of a human skull phantom by ultrasound methods using a two-dimensional array / S. A. Asfandiyarov, P. B. Rosnitskiy, S. A. Tsysar et al. // Acoustical Physics. — 2023. — Vol. 69. — P. 112–118. DOI: 10.1134/S106377102270004X
[10] Use of pulse-echo ultrasound imaging in transcranial diagnostics of brain structures / D. A. Sukhoruchkin, P. V. Yuldashev, S. A. Tsysar et al. // Bulletin of the Russian Academy of Sciences: Physics. — 2018. — Vol. 82, no. 5. — P. 507–511. DOI: 10.3103/S1062873818050283
[11] On the possibility of using multi-element phased arrays for shock-wave action on deep brain structures / P. Rosnitskiy, L. Gavrilov, P. Yuldashev et al. // Acoustical Physics. — 2017. — Vol. 63, no. 5. — P. 531–541. DOI: 10.1134/S1063771017050104
[12] A multi-element interstitial ultrasound applicator for the thermal therapy of brain tumors / M. Canney, F. Chavrier, S. Tsysar et al. // Journal of the Acoustical Society of America, 134 2 1647–1655. DOI: 10.1121/1.4812883